Glosario Química / Término
Ultravioleta, espectroscopía de
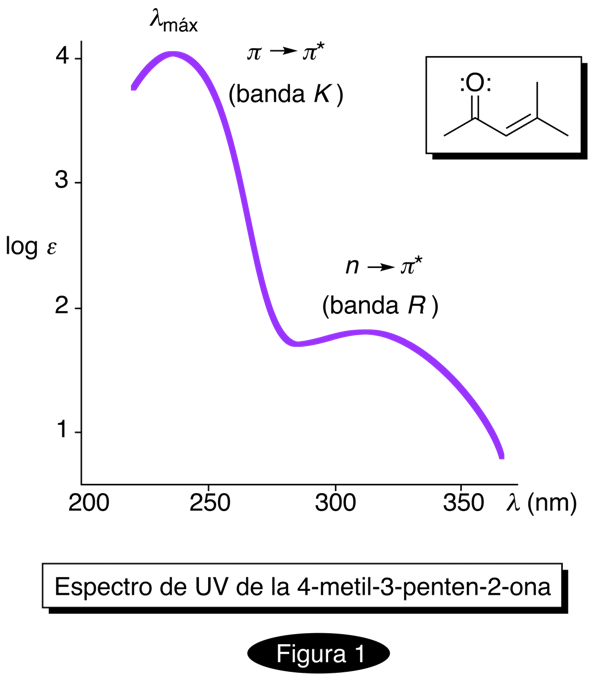
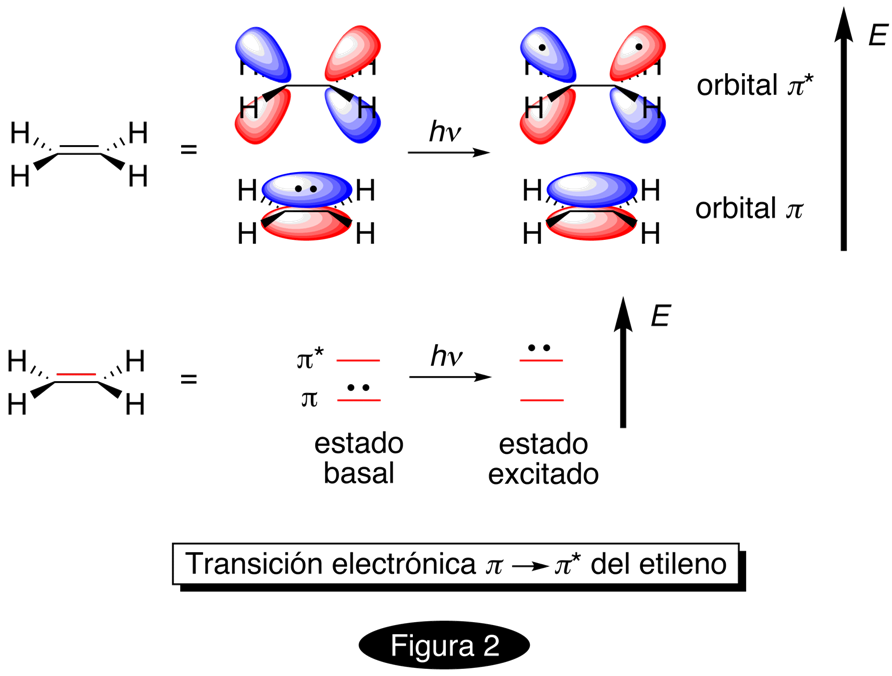
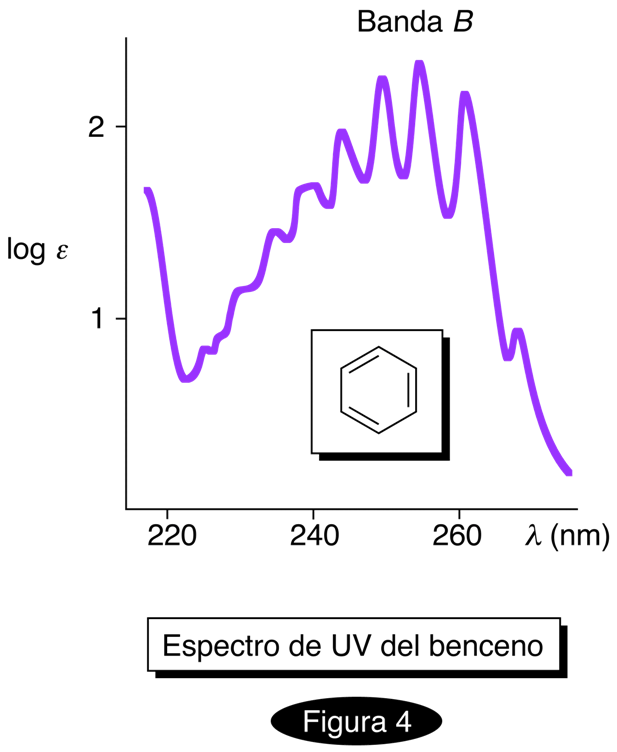
Técnica analítica no destructiva en donde las moléculas de una muestra son irradiadas con luz ultravioleta (UV) para inducir en ellas transiciones electrónicas con el objeto de extraer información acerca de su estructura. El intervalo de longitud de onda λ de la radiación con la que normalmente se hacen las mediciones se ubica entre los 200 y los 380 nanómetros (nm), siendo posible extender el análisis a valores de λ menores si se excluye por completo al oxígeno atmosférico de la medición. El proceso de transición, excitación o promoción electrónica consiste en transferir, transitoriamente, a los electrones de una molécula a un nivel de mayor contenido energético. Para entender esto, es necesario postular que una molécula posee orbitales de diferente energía que comprenden a todo el sistema de átomos que la constituyen, llamados orbitales moleculares; dichos orbitales poseen un contenido energético diverso, estableciéndose los electrones en aquéllos cuya energía sea la menor (de manera análoga a lo que acontece con los orbitales de un átomo), permaneciendo vacíos aquellos cuyo contenido energético sea elevado. Los rayos UV transfieren energía a electrones establecidos en orbitales moleculares de baja energía que por lo regular se encuentran involucrados en la constitución de un enlace pi (p) o sobre aquellos de naturaleza no enlazante (n, equivalentes con los pares de electrones no compartidos), pasando a ocupar un orbital molecular vacío, con lo que la transición se lleva a cabo. Los electrones que constituyen enlaces sigma, s, también pueden efectuar transiciones electrónicas si se emplean rayos UV de λ muy corta (de hasta 135 nm); sin embargo, tales transiciones carecen de interés analítico. La radiación que es absorbida por la muestra es registrada por el aparato con el que se hace la medición, llamado espectrómetro de UV-visible (la mayoría de ellos están adaptados para realizar mediciones también en el intervalo de la radiación del visible), y los resultados son expresados en términos de un espectro de ultravioleta, a partir del cual se obtiene la información estructural. Dicho espectro consta de una gráfica en donde en la coordenada horizontal se representa el valor de la longitud de onda de las diferentes radiaciones que se hacen incidir sobre la muestra, y en la vertical una escala en función de log e, que mide la intensidad con la que las diferentes radiaciones son absorbidas; e es el coeficiente de absortividad molar (antes coeficiente de extinción, término que no se debe utilizar más), una medición de la tendencia intrínseca de las moléculas de la muestra a absorber radiación. En ocasiones, log e es sustituido por una escala en función de la absorbancia, A, la cual, según la llamada Ley de Lambert-Beer (o simplmente Ley de Beer), equivale al producto de ebc, donde b = ancho de la cámara o celda en donde reside la solución de la sustancia que se analiza, dada en cm, y a través de la cual se hace pasar la radiación UV (las celdas están hechas de cuarzo y tienen la forma de un prisma); c = molaridad de la solución del analito, expresada en moles/litro. Las diferentes transiciones electrónicas que tienen lugar en la muestra se representan como sigue: si un electrón originalmente se enconraba en un orbital pi de enlace y es promovido a un orbital pi antienlazante, a la transición se le denota como p λ p•; si el orbital original es ahora uno no enlazante y el de llegada es nuevamente un pi antienlazante, se escribirá ahora n λ p•; etc. La absorción de luz UV no la ejecuta toda la molécula, sino cierto conjunto de átomos presentes en la misma denominado grupo cromóforo, pudiendo haber en una misma molécula varios de ellos. Un ejemplo de un cromóforo son los electrones pi involucrados en el enlace doble carbono-carbono del etileno: al irradiarlos con luz UV de 165 nm, se efectúa la transición p λ p• de uno de ellos, como se aprecia en la Fig. 2. En la Fig. 3 aparece una pequeña lista de algunos cromóforos importantes. Uno de los aspectos cuantitativos más importantes de esta técnica consiste en determinar el valor la longitud de onda que es absorbida por la muestra con la mayor intensidad, λmáx (si hay varios cromóforos presentes cada uno tenderá a absorber radiación UV de diferente longitud de onda). Regresando a la Fig. 1, en el espectro de la 4-metil-3-penten-2-ona hay dos máximos debido a la presencia de dos grupos cromóforos: uno correspondiente con una transición n λ p• (que involucra a los electrones sin compartir del átomo de oxígeno del grupo C=O) y otro p λ p• (correspondiente con la transición que sufre el enlace pi del grupo C=C); como puede verse en el espectro, es al primero de ellos al que le corresponde λmáx. Si diversas moléculas varían significativamente en sus estructuras pero comparten un mismo cromóforo, los valores de λmáx serán aproximadamente similares. Una contribución importante para que se den tales diferencias es la presencia de ciertos grupos funcionales saturados, denominados auxócromos (como -OH, -NH2), unidos al cromóforo. Si la absorción procede con una radiación de mayor longitud de onda que la del sistema básico del cromóforo, se dice que se ha presentado un desplazamiento batocrómico (o corrimiento hacia el rojo); si el efecto es el contrario, lo que se tiene es un desplazamiento hipsocrómico (o corrimiento hacia el azul). Ambos fenómenos son consecuencia de un cambio en la diferencia de energías que se presenta entre los orbitales moleculares involucrados en la transición al modificarse la estructura molecular básica del cromóforo. A veces se presenta también un incremento en la intensidad de λmáx (efecto hipercrómico) o un abatimiento (efecto hipsocrómico). Los espectros de UV frecuentemente son complejos (Fig. 4) como consecuencia de los diferentes modos o estados rotacionales y vibracionales que posee una molécula (v. espectroscopia de infrarrojo), lo que también origina que las bandas sean anchas. Los máximos de absorción a veces reciben nombres característicos (banda B, banda E, banda K, banda R) que las asocia a un cierto tipo de transición característica. Como técnica analítica, la espectroscopía de ultravioleta ha sido progresivamente abandonada en lo referente a la identificación de compuestos orgánicos, principalmente debido a los avances en la espectroscopia de resonancia magnética nuclear (v.) y en el análisis por difracción de rayos X (v.); hoy en día se le utiliza poco para tales fines en la química de productos naturales. No obstante, en otras ramas de la química y de la ciencia continúa vigente. En inglés: ultraviolet spectroscopy.
Enlace permanente: Ultravioleta, espectroscopía de - Fecha de creación: 2017-12-06
Novedades
Glosarios especializados
Este sitio web es posible gracias a que muestra publicidad en línea a sus visitantes.Por favor, ayude a que pueda seguir existiendo deshabilitando su bloqueador de anuncios (adblocker).
Muchas gracias.