Glosario Química / Término
Ácido
([Lat. acidus , ácido]) 1. un compuesto que libera iones de hidrógeno (H+) en solución (Arrhenius). 2. un compuesto que contiene iones de hidrógeno desmontable (Bronsted-Lowry) . 3. un compuesto que puede aceptar un par de electrones de una base (Lewis).
Según Brönsted-Lowry, es una especie química donadora del ion hidrógeno o que cede un protón a otra.
Es una entidad molecular capaz de donar un protón a una base, o las especies químicas que correspondan. Ejemplo: H2O , H3O+ , H2SO4 , HSO4-.
Toda sustancia que en solución puede donar protones. El papel tornasol azul se vuelve rojo al humedecerlo con una solución ácida.
Véase donante de protones.
Sustancia que libera iones de hidrógeno en solución, neutraliza las bases y dona protones.
Es aquella sustancia que dona un catión hidrógeno (H+) a otra sustancia llamada base. Puede existir en estado sólido, líquido o gas, dependiendo de la temperatura a la que se encuentre, ya sea en estado puro o en disolución.
Una sustancia que cuando se disuelve en agua se disocia y puede donar un hidrógeno (protón) a otra molécula. Son ejemplos el ácido sulfúrico y el ácido nítrico. Bajo estas condiciones, el ácido nítrico se disocia de acuerdo con la siguiente ecuación:
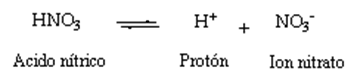
En agua los protones se anexan por sí mismos a las moléculas de agua, dando la siguiente ecuación:

Sustancia que libera iones hidrógeno (H+) cuando se disuelve en agua.
Enlace permanente: Ácido - Fecha de actualización: 2018-12-19 - Fecha de creación: 2017-12-06